Científicos transforman agua pura en 'metálica' a presión atmosférica
Una investigación liderada por cientistas químicos del Instituto de Química Orgánica y Bioquímica de la Academia de Ciencias Checa descubrieron que una solución de agua metálica puede ser obtenida al hacer reaccionar agua con metales alcalinos.

El agua pura es un aislante casi perfecto. Sí, el agua encontrada en la naturaleza conduce electricidad debido a las impurezas que contiene, que se disuelven en iones libres y permiten el flujo de corrientes eléctricas. El agua pura solamente se vuelve "metálica" (electrónicamente conductora) a presiones extremamente altas, que van más allá de nuestra capacidad actual.
Sin embargo, como los investigadores demostraron, por la primera vez, no es apenas las altas presiones que pueden inducir esta condición en el agua pura. Al colocar agua pura en contacto con un metal alcalino, compartiendo electrones -en este caso, una liga de sodio y potasio-, partículas cargadas de movimiento libre pueden ser adicionadas, volviendo el agua metálica.
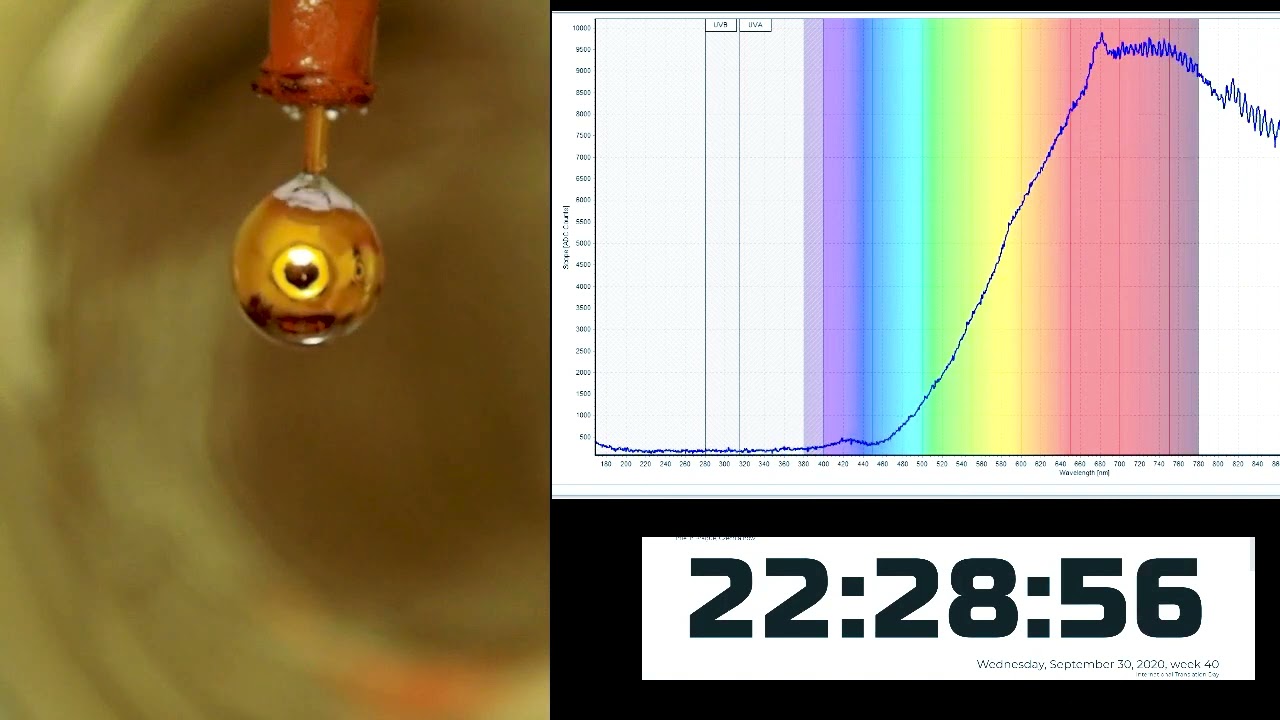
El profesor Jungwirth, junto a sus colegas de la República Checa, de Estados Unidos, de Alemania, de Egipto y Japón, expusieron una gota de liga de sodio y potasio (NaK) a una pequeña cantidad de vapor de agua, que comenzó a condensar en su superficie.
La conductividad resultante dura apenas algunos segundos, pero es un paso significativo entender esa fase del agua al estudiarla directamente.
Bajo condiciones de presión lo suficientemente altas, prácticamente cualquier metal podría -teóricamente- transformarse en un conductor. La idea es que, al comprimirse los átomos con suficiente fuerza, las órbitas de los electrones externos comenzarían a sobreponerse, permitiendo que se muevan. En el caso del agua, esa presión es de cerca de 48 Mbar, cerca de 48 millones de veces más que la presión atmosférica en la Tierra a nivel del mar.
Aunque presiones mucho más elevadas han sido generadas en ambiente de laboratorio, tales experimentos serían inadecuados para estudiar agua metálica. Así, un grupo de investigadores liderado por el químico orgánico Pavel Jungwirth, de la Academia de Ciencias Checa, se direccionó hacia el estudio con metales alcalinos.
Agua al metal y no metal al agua
Como los metales alcalinos liberan sus electrones externos con mucha facilidad, pueden inducir sus propiedades de compartir electrones del agua pura, sin la necesidad de someterla a altas presiones. Hay apenas un problema: los metales alcalinos son altamente reactivos con el agua líquida, ¡al punto de llegar a ser explosivos!

El equipo logró encontrar una forma muy interesante de burlar este problema. ¿E si, en lugar de adicionar metal al agua, se adicionase agua al metal? En una cámara de vacío, el grupo comenzó realizando la extrusión de una pequeña burbuja de liga de sodio y potasio -que se encuentra en estado líquido a temperatura ambiente-, y con mucho cuidado adicionó una fina película de agua pura mediante a deposición del vapor.
Um grupo de cientistas de Química Orgânica e Bioquímica de vários países conseguiram transformar água pura em metal dentro de uma câmara a vácuo controlando as condições de pressão. pic.twitter.com/XPlxbJaJgk
— Davi Moura (@DaviMoura__) July 31, 2021
El contacto entre el agua y el metal hacen con que los electrones y los cationes metálicos (iones cargados positivamente) fluyan de la liga hacia el agua. Esto no sólo hace que el agua gane un color dorado, sino que también le da conductividad; exactamente como debería ser visto en agua pura metálica sometida a altas presiones.
Cómo puede el agua caliente congelarse antes que la fría.
Esto fue confirmado usando espectroscopía de reflexión óptica y espectroscopía de fotoelectrones de rayos X sincrotrón. Las dos propiedades -el brillo dorado y la banda conductiva- ocupan dos franjas de frecuencia diferentes, lo que permitía que ambas fuesen identificadas claramente.
Además de darnos una mejor comprensión de esa transición de fase aquí en la Tierra, la investigación también podría permitir un estudio detallado de las condiciones de presiones extremamente altas dentro de los grandes planetas.








