¿Para qué sirve? Cómo entender la tabla periódica de elementos químicos
Para un químico o cualquier especialista en las ciencias naturales, la tabla periódica es una herramienta esencial en su trabajo. Poder identificar un elemento químico de otro, analizar su comportamiento y predecir posibles propiedades de una nueva sustancia son algunas de sus utilidades.

A finales del siglo XIX, la Química tuvo un auge importante con la creación de la tabla periódica de los elementos. Por primera vez en 1869, todas las sustancias químicas descubiertas hasta el momento fueron dispuestas en un registro organizado según su número atómico, propiedades y características. Debemos el invento de la tabla periódica al químico ruso Dimitri Mendeléyev: la primera clasificación contaba con 17 columnas, o grupos, como se les conoce ahora.
Desde entonces, la tabla periódica ha sido mejorada y actualizada con nuevas sustancias descubiertas en la naturaleza o creadas artificialmente por científicos. Está compuesta por 118 elementos confirmados por la Unión Internacional de Química Pura y Aplicada (IUPAC, por sus siglas en inglés), y cuenta con 18 grupos, lo que permite identificarlos según sus propiedades.
El orden está dado según su número atómico: el primero es el hidrógeno (H), cuyo número atómico es el más bajo de la tabla periódica. Esto nos permite comprender, por ejemplo, que el hidrógeno tiene 1 protón y el oganesón (Og) tiene 118, siendo este último el de mayor número atómico.
Pasos para entender una tabla periódica
Tomemos un elemento químico al azar: el boro será, en este caso, el elegido. El símbolo químico que lo representa es la letra B. Si lo buscamos en la tabla periódica, encontramos que su número atómico es 5 –es decir, que un átomo de boro tiene 5 protones en su núcleo– y su masa atómica es de 10,811. Es un metaloide, semiconductor y se presenta naturalmente en el mineral bórax. Tiene disímiles usos, entre ellos en la industria textil, y está en la composición del detergente en polvo.
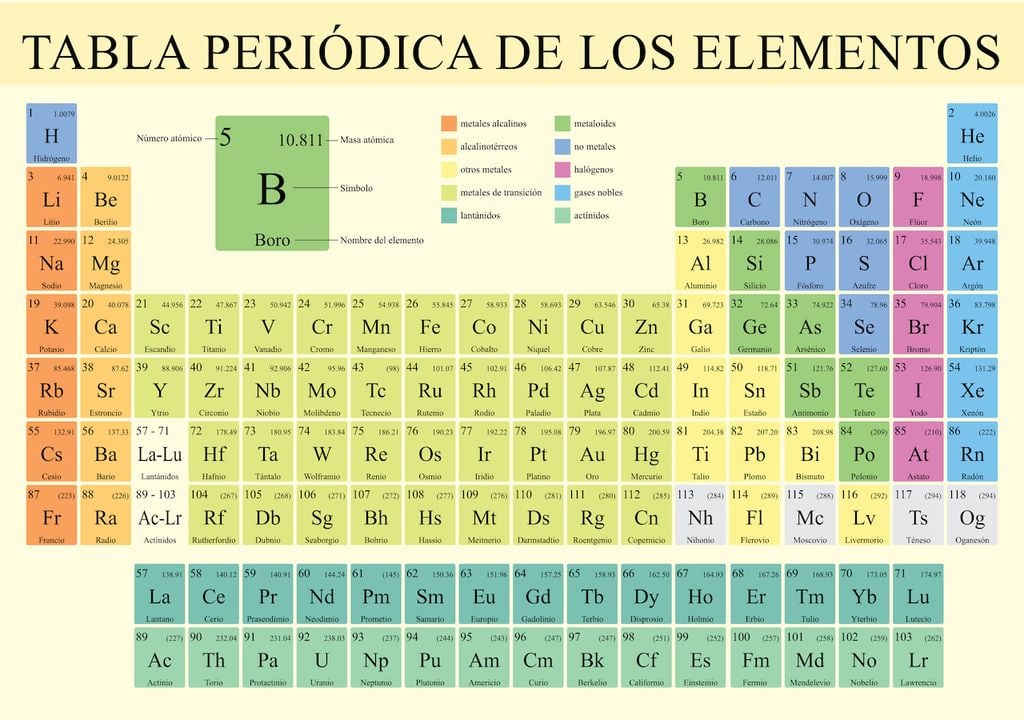
Así, podríamos interpretar cada elemento y conocer en qué se emplea. Pero esto no es todo: en la tabla periódica se clasifican las sustancias según sus propiedades en grupos y en períodos de acuerdo con la cantidad de capas de electrones que tengan.
Grupos
Esta clasificación consiste en 18 columnas verticales, que parten con el grupo de los alcalinos y terminan con el de los gases nobles. Cada grupo determina una característica química particular de esos elementos, que depende de cómo se estructuran los electrones en la última capa del átomo.
| Número Grupo | Clasificación | Características | Ejemplos |
|---|---|---|---|
1 | Metales alcalinos | Metales blandos, altamente reactivos. | Sodio (Na) |
| 2 | Metales alcalinotérreos | Metales más duros, buenos conductores eléctricos. | Calcio (Ca) |
| 8 | Familia del hierro | Metales de transición, poseen comportamientos representativos del elemento principal (hierro, Fe). | Hassio (Hs) |
| 17 | Halógenos | Oxidantes, muy reactivos. | Cloro (Cl) |
| 18 | Gases nobles | Moléculas monoatómicas, no reaccionan con otros elementos (gases inertes). | Helio (He) |
| Ejemplo de grupos pertenecientes a la tabla periódica de elementos. | |||
Períodos
Corresponden a 7 filas horizontales. En ellas se distinguen los elementos que presentan igual número de capas de electrones, que a su vez coincide con el número del período.
Siguiendo con el ejemplo del boro, veremos que se encuentra en el grupo 13 y período 2. Esto quiere decir que pertenece al grupo de los térreos, cuya característica distintiva es que tienen tres electrones en su capa más externa y que presenta dos niveles energéticos.
Entonces... ¿Por qué es importante?
En la última actualización de la tabla periódica (4 de mayo de 2022), aparecen los pesos atómicos más recientes, publicados por la Comisión de Abundancias Isotópicas y Pesos Atómicos de la IUPAC (CIAAW), cuyas cifras poseen gran precisión.
In case you are wondering why @IUPAC has recently updated the Periodic Table, take a look at https://t.co/E5FpES1QaQ and visit the Periodic Table of the Isotopes https://t.co/YlGnwiA8Az
— JavierGarciaMartinez (@javiergarciamar) May 17, 2022
You will learn why isotopes matter and the need for constantly updating atomic weights! pic.twitter.com/CrkyA7k1A5
En la tabla periódica, también podemos analizar las tendencias periódicas. La electronegatividad, la energía de ionización o el radio atómico son algunas de las propiedades que permite asociar a cada elemento.
Hemos visto que, en Química, la tabla periódica es esencial: es útil para identificar similitudes y diferencias entre elementos; se emplea para analizar su comportamiento químico; facilita identificar los elementos a partir de su número atómico. Y así podríamos continuar enumerando sus funciones. No te desanimes si te cuesta entenderla, porque una vez que lo logres te fascinará.








